Лютэцый— рэдкі рэдказямельны элемент з высокімі коштамі, мінімальнымі запасамі і абмежаваным ужываннем. Ён мяккі і раствараецца ў разведзеных кіслотах і можа павольна рэагаваць з вадой.
Да прыродных ізатопаў адносяцца 175Lu, перыяд паўраспаду якіх складае 2,1 × 10⁻⁶ гадоў. β-выпраменьвальнік 176Lu атрымліваецца шляхам аднаўлення фтарыду лютэцыя (III) LuF∨·2H₂O кальцыем.
Асноўнае прымяненне - у якасці каталізатара для рэакцый крэкінгу нафты, алкілавання, гідрагенізацыі і палімерызацыі; Акрамя таго, танталат лютэцыя таксама можа быць выкарыстаны ў якасці матэрыялу для рэнтгенафлуарэсцэнтнага парашка; 177Lu, радыенуклід, можа быць выкарыстаны для прамянёвай тэрапіі пухлін.

Адкрыццё гісторыі
Адкрыў: Г. Урбан
Адкрыты ў 1907 годзе
Лютэцый быў аддзелены ад ітэрбію французскім хімікам Ульбанам у 1907 годзе і таксама быў рэдказямельным элементам, адкрытым і пацверджаным у пачатку 20 стагоддзя. Лацінская назва лютэцый паходзіць ад старажытнай назвы Парыжа, Францыя, які з'яўляецца радзімай Урбана. Адкрыццё лютэцый і яшчэ аднаго рэдказямельнага элемента — еўропію — завяршыла адкрыццё ўсіх рэдказямельных элементаў, якія прысутнічаюць у прыродзе. Іх адкрыццё можна лічыць адкрыццём чацвёртых варот да адкрыцця рэдказямельных элементаў і завяршэннем чацвёртага этапу адкрыцця рэдказямельных элементаў.
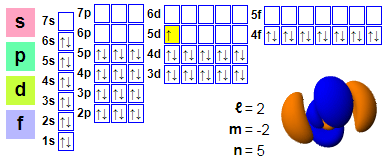
Электронная канфігурацыя
Электронныя дамоўленасці:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d1
Лютэцый — гэта серабрыста-белы метал, які з'яўляецца самым цвёрдым і шчыльным металам сярод рэдказямельных элементаў; тэмпература плаўлення 1663 ℃, тэмпература кіпення 3395 ℃, шчыльнасць 9,8404. Лютэцый адносна ўстойлівы на паветры; аксід лютэцыю — гэта бясколерны крышталь, які раствараецца ў кіслотах з утварэннем адпаведных бясколерных соляў.
Бляск лютэцыю, які з'яўляецца рэдказямельным металам, знаходзіцца паміж срэбрам і жалезам. Змест прымешак істотна ўплывае на іх уласцівасці, таму ў літаратуры часта сустракаюцца істотныя адрозненні ў іх фізічных уласцівасцях.
Металічныя ітрый, гадаліній і лютэцый валодаюць высокай каразійнай устойлівасцю і могуць доўга захоўваць свой металічны бляск.
Прыкладанне
З-за цяжкасцей у вытворчасці і высокіх цэн лютэцый мае мала камерцыйнага прымянення. Уласцівасці лютэцыю не істотна адрозніваюцца ад іншых лантанідавых металаў, але яго запасы адносна меншыя, таму ў многіх месцах для замены лютэцыю звычайна выкарыстоўваюцца іншыя лантанідавыя металы.
Лютэцый можа выкарыстоўвацца для вырабу некаторых спецыяльных сплаваў, такіх як алюмініевы сплаў лютэцыя, які можа выкарыстоўвацца для нейтронна-актывацыйнага аналізу. Лютэцый таксама можа выкарыстоўвацца ў якасці каталізатара для рэакцый крэкінгу нафты, алкілавання, гідрагенізацыі і палімерызацыі. Акрамя таго, легіраванне лютэцыям некаторых лазерных крышталяў, такіх як ітрыевы алюмініевы гранат, можа палепшыць яго лазерныя характарыстыкі і аптычную аднастайнасць. Акрамя таго, лютэцый таксама можа выкарыстоўвацца для люмінафораў: танталат лютэцыя - самы кампактны белы матэрыял з вядомых у цяперашні час і з'яўляецца ідэальным матэрыялам для рэнтгенаўскіх люмінафораў.
177Lu — гэта сінтэтычны радыенуклід, які можа выкарыстоўвацца для прамянёвай тэрапіі пухлін.
Аксід лютэцыякрышталь сілікатаў цэрыя ітрыю лютэцыя
Час публікацыі: 26 чэрвеня 2023 г.