SкандыйСкандый, з сімвалам элемента Sc і атамным нумарам 21, лёгка раствараецца ў вадзе, можа ўзаемадзейнічаць з гарачай вадой і лёгка цямнее на паветры. Яго галоўная валентнасць роўная +3. Часта яго змешваюць з гадалініем, эрбіем і іншымі элементамі, з нізкім выхадам і ўтрыманнем прыблізна 0,0005% у зямной кары. Скандый часта выкарыстоўваецца для вырабу спецыяльнага шкла і лёгкіх тэмпературнастойкіх сплаваў.
У цяперашні час даказаныя запасы скандыя ў свеце складаюць усяго 2 мільёны тон, 90-95% якіх утрымліваецца ў баксітах, фасфарытах і жалеза-тытанавых рудах, а невялікая частка - уранавых, торыевых, вальфрамавых і рэдказямельных рудах, якія ў асноўным распаўсюджаны ў Расіі, Кітаі, Таджыкістане, Мадагаскары, Нарвегіі і іншых краінах. Кітай вельмі багаты на рэсурсы скандыя, з велізарнымі мінеральнымі запасамі, звязанымі са скандыям. Паводле няпоўнай статыстыкі, запасы скандыя ў Кітаі складаюць каля 600 000 тон, якія ўтрымліваюцца ў радовішчах баксітаў і фасфарытаў, радовішчах парфіру і кварцавага жыльнага вальфраму ў Паўднёвым Кітаі, радовішчах рэдказямельных радовішчаў у Паўднёвым Кітаі, радовішчы рэдказямельных жалезазялёных руд Баян-Оба ва Унутранай Манголіі і радовішчы ванадыю-тытан-магнетыту Паньчжыхуа ў правінцыі Сычуань.
З-за дэфіцыту скандыю цана на яго таксама вельмі высокая, і на піку яна вырасла ў 10 разоў вышэй за цану золата. Нягледзячы на тое, што цана на скандый упала, яна ўсё яшчэ ў чатыры разы вышэйшая за цану золата!
Адкрыццё гісторыі
У 1869 годзе Мендзялееў заўважыў разрыў у атамнай масе паміж кальцыем (40) і тытанам (48) і прадказаў, што тут таксама існуе неадкрыты прамежкавы элемент з атамнай масай. Ён прадказаў, што яго аксід — X ₂ O Å. Скандый быў адкрыты ў 1879 годзе Ларсам Фрэдэрыкам Нільсанам з Упсальскага ўніверсітэта ў Швецыі. Ён здабыў яго з чорнай залатой шахты, складанай руды, якая змяшчае 8 тыпаў аксідаў металаў. Ён здабыўАксід эрбія(III)з чорнай рэдкай залатой руды і атрыманайАксід ітэрбію(III)з гэтага аксіду ўтвараецца іншы аксід лягчэйшага элемента, спектр якога паказвае, што гэта невядомы метал. Гэта метал, прадказаны Мендзялеевым, аксід якога...Sc₂O₃Сам металічны скандый быў атрыманы зХларыд скандыяшляхам электралітычнага плаўлення ў 1937 годзе.
Мендзялееў
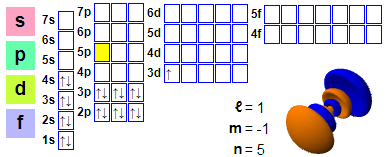
Электронная канфігурацыя
Электронная канфігурацыя: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Скандый — мяккі пераходны метал серабрыста-белага колеру з тэмпературай плаўлення 1541 ℃ і тэмпературай кіпення 2831 ℃.
На працягу значнага перыяду часу пасля адкрыцця скандыю яго выкарыстанне не дэманстравалася з-за складанасці яго вытворчасці. З удасканаленнем метадаў падзелу рэдказямельных элементаў у цяперашні час існуе развіты тэхналагічны працэс ачысткі злучэнняў скандыю. Паколькі скандый менш шчолачны, чым ітрый і лантаніды, гідраксід з'яўляецца найслабейшым, таму змешаны мінерал рэдказямельных элементаў, які змяшчае скандый, будзе аддзелены ад рэдказямельнага элемента метадам «ступенчатага асаджэння», калі гідраксід скандыю (III) апрацоўваюць аміякам пасля пераводу ў раствор. Іншы метад - аддзяленне нітрату скандыю палярным раскладаннем нітрату. Паколькі нітрат скандыю лягчэй за ўсё раскладаецца, скандый можна аддзяліць. Акрамя таго, важнай крыніцай скандыю з'яўляецца комплекснае здабыванне суправаджальнага скандыю з радовішчаў урану, торыю, вальфраму, волава і іншых карысных выкапняў.
Пасля атрымання чыстага злучэння скандыю яго пераўтвараюць у ScCl Å і сумесна плаўляць з KCl і LiCl. Расплаўлены цынк выкарыстоўваецца ў якасці катода для электролізу, у выніку чаго скандый выпадае ў асадак на цынкавым электродзе. Затым цынк выпараюць, каб атрымаць металічны скандый. Гэта лёгкі серабрыста-белы метал з вельмі актыўнымі хімічнымі ўласцівасцямі, які можа рэагаваць з гарачай вадой з утварэннем вадароду. Такім чынам, металічны скандый, які вы бачыце на малюнку, герметычна запячатаны ў бутэльку і абаронены аргонам, інакш скандый хутка ўтворыць цёмна-жоўты або шэры аксідны пласт, губляючы свой бліскучы металічны бляск.
Прыкладанні
Асвятляльная прамысловасць
Скандый выкарыстоўваецца ў вельмі яркіх напрамках, і не будзе перабольшаннем назваць яго Сынам Святла. Першая чароўная зброя скандыю называецца скандыевай натрыевай лямпай, якая можа быць выкарыстана для асвятлення тысяч хатніх гаспадарак. Гэта металагалогенные электрычныя лямпы: лямпачка запоўнена ёдыдам натрыю і трыёдыдам скандыю, і адначасова дадаюцца скандыевая і натрыевая фальга. Падчас высокавольтнага разраду іоны скандыю і іоны натрыю адпаведна выпраменьваюць святло сваіх характэрных даўжынь хваль выпраменьвання. Спектральныя лініі натрыю маюць даўжыні хваль 589,0 і 589,6 нм, два вядомыя жоўтыя выпраменьванні, у той час як спектральныя лініі скандыю маюць даўжыню хваль 361,3~424,7 нм, серыю выпраменьванняў блізкага ультрафіялетавага і сіняга святла. Паколькі яны дапаўняюць адзін аднаго, агульны колер святла, які атрымліваецца, — белы. Менавіта таму, што скандыевыя натрыевыя лямпы валодаюць характарыстыкамі высокай светлавой эфектыўнасці, добрага колеру святла, энергазберажэння, працяглага тэрміну службы і высокай здольнасці распальваць туман, яны могуць шырока выкарыстоўвацца для тэлевізійных камер, асвятлення плошчаў, спартыўных пляцовак і дарог, і вядомыя як крыніцы святла трэцяга пакалення. У Кітаі гэты тып лямпаў паступова прасоўваецца як новая тэхналогія, у той час як у некаторых развітых краінах гэты тып лямпаў шырока выкарыстоўваўся яшчэ ў пачатку 1980-х гадоў.
Другая чароўная зброя скандыю — гэта сонечныя фотаэлектрычныя элементы, якія могуць збіраць святло, рассеянае на зямлі, і пераўтвараць яго ў электрычнасць для харчавання чалавецтва. Скандый — найлепшы бар'ерны метал у металічных ізалятарах, паўправадніковых крэмніевых сонечных элементах і сонечных элементах.
Яго трэцяя магічная зброя называецца крыніцай γ-A прамянёў. Гэтая магічная зброя можа ярка ззяць самастойна, але такое святло нельга ўбачыць няўзброеным вокам, гэта паток фатонаў высокай энергіі. Звычайна мы здабываем 45Sc з мінералаў, які з'яўляецца адзіным прыродным ізатопам скандыя. Кожнае ядро 45Sc змяшчае 21 пратон і 24 нейтроны. 46Sc, штучны радыеактыўны ізатоп, можа выкарыстоўвацца ў якасці крыніц γ-выпраменьвання або трасерных атамаў, а таксама можа выкарыстоўвацца для прамянёвай тэрапіі злаякасных пухлін. Існуюць таксама такія прымяненні, як ітрыевы галій-скандыевы гранатавы лазер.Фтарыд скандыюШкляное інфрачырвонае аптычнае валакно і электронна-прамянёвая трубка са скандыевым пакрыццём на тэлебачанні. Здаецца, што скандый нараджаецца з яркасцю.
Сплаўная прамысловасць
Скандый у сваёй элементарнай форме шырока выкарыстоўваецца для легіравання алюмініевых сплаваў. Дастаткова некалькіх тысячных доляў скандыю дадаваць да алюмінію, каб утварылася новая фаза Al3Sc, якая будзе гуляць ролю метамарфізму ў алюмініевым сплаве і значна змяніць структуру і ўласцівасці сплаву. Даданне 0,2%~0,4% Sc (што вельмі падобна на прапорцыю дадання солі да смажанай гародніны ў хатніх умовах, патрэбна зусім няшмат) можа павялічыць тэмпературу перакрышталізацыі сплаву на 150-200 ℃ і значна палепшыць трываласць пры высокіх тэмпературах, структурную стабільнасць, зварачныя характарыстыкі і каразійную стойкасць. Гэта таксама дазваляе пазбегнуць з'явы охрупчвання, якая лёгка ўзнікае пры працяглай працы пры высокіх тэмпературах. Высокатрывалыя і высокатрывалыя алюмініевыя сплавы, новыя высокатрывалыя каразійна-ўстойлівыя зварныя алюмініевыя сплавы, новыя высокатэмпературныя алюмініевыя сплавы, высокатрывалыя, устойлівыя да нейтроннага апраменьвання алюмініевыя сплавы і г.д. маюць вельмі прывабныя перспектывы развіцця ў аэракасмічнай прамысловасці, авіяцыі, караблях, ядзерных рэактарах, лёгкіх транспартных сродках і хуткасных цягніках.
Скандый таксама з'яўляецца выдатным мадыфікатарам жалеза, і невялікая колькасць скандыю можа значна палепшыць трываласць і цвёрдасць чыгуну. Акрамя таго, скандый таксама можа выкарыстоўвацца ў якасці дабаўкі для высокатэмпературных вальфрамавых і хромавых сплаваў. Вядома, акрамя вырабу вясельнай вопраткі для іншых, скандый мае высокую тэмпературу плаўлення, а яго шчыльнасць падобная да алюмінію, і таксама выкарыстоўваецца ў лёгкіх сплавах з высокай тэмпературай плаўлення, такіх як тытанавы сплаў скандыю і магніевы сплаў скандыю. Аднак з-за высокай цаны ён звычайна выкарыстоўваецца толькі ў высакаякасных вытворчых галінах, такіх як касмічныя шатлы і ракеты.
Керамічны матэрыял
Скандый, асобнае рэчыва, звычайна выкарыстоўваецца ў сплавах, і яго аксіды гуляюць важную ролю ў керамічных матэрыялах падобным чынам. Тэтраганальны керамічны матэрыял на аснове дыяксіду цырконія, які можа быць выкарыстаны ў якасці электроднага матэрыялу для цвёрдааксідных паліўных элементаў, мае ўнікальную ўласцівасць, заключаючыся ў тым, што праводнасць гэтага электраліта павялічваецца з павышэннем тэмпературы і канцэнтрацыі кіслароду ў навакольным асяроддзі. Аднак крышталічная структура гэтага керамічнага матэрыялу сама па сабе не можа існаваць стабільна і не мае прамысловай каштоўнасці; неабходна легіраванне некаторымі рэчывамі, якія могуць зафіксаваць гэтую структуру, каб захаваць яе першапачатковыя ўласцівасці. Даданне 6~10% аксіду скандыя падобна на бетонную структуру, таму дыяксід цырконія можна стабілізаваць на квадратнай рашотцы.
Існуюць таксама інжынерныя керамічныя матэрыялы, такія як высокатрывалы і ўстойлівы да высокіх тэмператур нітрыд крэмнію, у якасці ўшчыльняльнікаў і стабілізатараў.
Як ушчыльняльнік,Аксід скандыюможа ўтвараць тугаплаўкую фазу Sc2Si2O7 на краі дробных часціц, тым самым памяншаючы высокатэмпературную дэфармацыю інжынернай керамікі. У параўнанні з іншымі аксідамі, ён можа лепш палепшыць высокатэмпературныя механічныя ўласцівасці нітрыду крэмнію.
Каталітычная хімія
У хімічнай тэхналогіі скандый часта выкарыстоўваецца ў якасці каталізатара, а Sc2O3 можа быць выкарыстаны для дэгідратацыі і дэакіслення этанолу або ізапрапанолу, раскладання воцатнай кіслаты і атрымання этылену з CO і H2. Каталізатар PtAl, які змяшчае Sc2O3, таксама з'яўляецца важным каталізатарам для працэсаў ачысткі і перапрацоўкі цяжкай нафты шляхам гідрагенізацыі ў нафтахімічнай прамысловасці. У рэакцыях каталітычнага крэкінгу, такіх як кумол, актыўнасць цэалітавага каталізатара Sc-Y у 1000 разоў вышэйшая, чым у алюмініева-сілікатнага каталізатара; у параўнанні з некаторымі традыцыйнымі каталізатарамі, перспектывы развіцця скандыевых каталізатараў будуць вельмі светлымі.
Атамная энергетыка
Даданне невялікай колькасці Sc2O3 да UO2 у ядзерным паліве высокатэмпературнага рэактара можа пазбегнуць пераўтварэння рашоткі, павелічэння аб'ёму і расколін, выкліканых пераўтварэннем UO2 у U3O8.
Паліўны элемент
Аналагічна, даданне ад 2,5% да 25% скандыя ў нікель-шчолачныя акумулятары павялічыць тэрмін іх службы.
Сельскагаспадарчая селекцыя
У сельскай гаспадарцы насенне, такое як кукуруза, буракі, гарох, пшаніца і сланечнік, можна апрацоўваць сульфатам скандыю (канцэнтрацыя звычайна складае 10⁻³~10⁻⁶ моль/л, розныя расліны будуць мець розную канцэнтрацыю), і фактычны эфект стымулявання прарастання быў дасягнуты. Праз 8 гадзін сухая маса каранёў і пупышак павялічылася на 37% і 78% адпаведна ў параўнанні з расадай, але механізм гэтага дзеяння ўсё яшчэ вывучаецца.
З таго часу, як Нільсэн звярнуў увагу на даўгі дадзеных аб атамнай масе, скандый трапіў у поле зроку людзей усяго сто ці дваццаць гадоў таму, але ён амаль што заставаўся ў мінулым стагоддзі. Толькі бурнае развіццё матэрыялазнаўства ў канцы мінулага стагоддзя надало яму жыццё. Сёння рэдказямельныя элементы, у тым ліку скандый, сталі гарачымі зоркамі ў матэрыялазнаўстве, адыгрываючы пастаянна зменлівую ролю ў тысячах сістэм, штодня прыносячы больш зручнасці ў наша жыццё і ствараючы эканамічную каштоўнасць, якую яшчэ цяжэй вымераць.
Час публікацыі: 29 чэрвеня 2023 г.